Raggiunta una nuova tappa nella conoscenza del funzionamento dei muscoli. Un team di ricerca guidato da ricercatori dell’Università di Firenze ha fatto luce sulle proprietà meccaniche della titina, una delle proteine accessorie che regolano la contrazione muscolare.
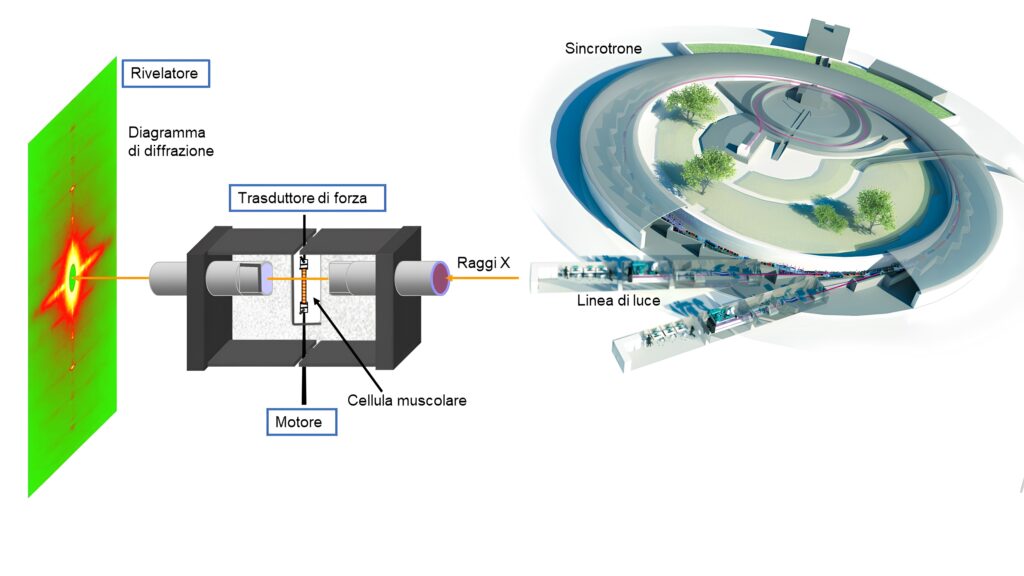
Lo studio, pubblicato su PNAS, è stato capitanato da un team dell’Unità di Ricerca PhysioLab dell’Università di Firenze, in collaborazione con la Magyar Tudomanyos Akademia (Budapest, Ungheria) e l’European Synchrotron Radiation Facility (Grenoble, Francia) [“Titin activates myosin filaments in skeletal muscle by switching from an extensible spring to a mechanical rectifier” https://doi.org/10.1073/pnas.2219346120 ]. La ricerca è stata possibile grazie all’uso della linea di luce ID02 che il Sincrotrone Europeo ha concesso ai ricercatori del PhysioLab e al sostegno della Fondazione CR Firenze.
“La contrazione dei muscoli e del cuore – spiega Vincenzo Lombardi, professore emerito dell’Ateneo fiorentino che collabora alla ricerca del PhysioLab – è dovuta all’azione delle proteine contrattili miosina (il motore molecolare del muscolo) e actina organizzate rispettivamente in filamenti spessi e sottili nel sarcomero, l’unità strutturale della cellula muscolare. I motori miosinici prendono contatto con i filamenti sottili adiacenti e generano forza e accorciamento tirandoli verso il centro del sarcomero. L’attività delle proteine contrattili miosina e actina è regolata da altre proteine accessorie, presenti sia sul filamento spesso che sul filamento sottile. La proteina accessoria titina è una proteina filamentosa così grande che si estende per tutta la lunghezza del sarcomero prendendo contatto sia col filamento spesso che col filamento sottile. Mutazioni nei geni che codificano le proteine accessorie sono la causa principale delle miopatie del muscolo scheletrico e cardiaco”.
Le proprietà meccaniche della titina nel muscolo attivo sono molto difficili da studiare, poiché vengono mascherate dalla preponderante azione meccanica dei motori di miosina. Le misure delle proprietà meccaniche della titina finora disponibili erano quelle nel muscolo a riposo che indicavano che la molecola è estremamente estensibile e quindi inadatta a svolgere un ruolo di raccordo per trasmettere le variazioni di carico al filamento spesso. Nella ricerca pubblicata su PNAS, sfruttando la proprietà di una piccola molecola organica, sviluppata nel laboratorio di Budapest, che si lega ai motori di miosina e ne elimina selettivamente l’azione, si è potuto studiare l’azione della titina nel muscolo attivo, isolata dagli altri fattori in gioco. “Si è così scoperto – spiega Caterina Squarci, assegnista del dipartimento fiorentino di Biologia che ha lavorato a questo progetto nell’ambito della sua tesi di dottorato -, che in seguito alla stimolazione del muscolo la titina acquisisce le proprietà di un raddrizzatore meccanico: risponde ad aumenti del carico con una resistenza cento volte maggiore di quella a riposo che la rende capace di attivare il filamento spesso trasmettendogli efficacemente l’aumento di carico, mentre non offre alcuna resistenza all’accorciamento prodotto da riduzioni del carico e pertanto mantiene inalterata la capacità del muscolo attivo di accorciarsi sotto l’azione dei motori di miosina”.
“Per comprendere il ruolo di queste proprietà meccaniche della titina nella regolazione della contrazione – spiega Gabriella Piazzesi, responsabile del progetto – abbiamo usato la diffrazione di raggi X alla linea di luce ID02 del sincrotrone europeo (ESRF, Grenoble). L’enorme intensità del fascio di luce prodotto dal sincrotrone permette di registrare da una cellula muscolare le modifiche strutturali su scala nanometrica provenienti dalle proteine contrattili lungo i filamenti durante le stesse manovre meccaniche applicate nel laboratorio di Firenze alle fibre muscolari isolate. Si è così rivelato – prosegue Piazzesi – come, in seguito all’attivazione del muscolo, la titina modifica l’orientamento dei motori di miosina in funzione del carico, favorendo la loro interazione con i filamenti di actina”.
“Molte miopatie del muscolo scheletrico e cardiaco – conclude Vincenzo Lombardi -, sono associate a mutazioni della titina: descrivere il meccanismo con cui essa agisce nell’attivazione dei motori di miosina è una tappa fondamentale per studi futuri volti a definire gli effetti delle mutazioni della titina su questa funzione e sviluppare in modo efficace terapie specifiche.